Os achados da biópsia sugestivos de retocolite ulcerativa incluem abscesso de cripta, ramificação das criptas, encurtamento, desarranjo e atrofia de criptas. Anormalidades celulares incluem depleção de mucina e metaplasia das células de Paneth; achados inflamatórios incluem aumento da celularidade da lâmina própria, plasmocitose basal, agregados linfoides e eosinófilos na lâmina própria.
Histologicamente, são observados na doença de Crohn granulomas não caseosos (presentes em 30% dos casos, são diagnósticos se excluídas infecções), acometimento transmural, ulcerações focais e reação inflamatória crônica e aguda inespecífica.
Causas mais comuns de hematoquezia: diverticulose 5 a 42%, isquemia 6 a 18%, doença anorretal (hemorroidas, fissura) 6 a 16%, neoplasia 3 a 11% e angiodisplasia 0 a 3%.
Anemia ferropriva por perda de sangue não visível é mais comum no câncer do cólon direito.
O sangramento ocorre em, aproximadamente, 20% dos pacientes com úlcera duodenal, além de ser mais comum nesta do que na gástrica. Clinicamente, manifesta-se como hematêmese, melena ou ambas. Grande sangramento (mais de 1.000mL) pode manifestar-se com hematoquezia e, em 15% dos casos, apresentar-se, inicialmente, com choque hipovolêmico.
Antibioticoprofilaxia está indicada aos pacientes de alto risco para infecção que incluem idade >70 anos, colecistite aguda, vesícula biliar não funcionante, icterícia obstrutiva e coledocolitíase. Sobre colecistectomia laparoscópica eletiva sem fator de risco, há trials recentes mostrando não haver diminuição do risco de infecção com profilaxia. E está indicada profilaxia para procedimentos envolvendo cólon ou reto.
A polipose adenomatosa familiar é caracterizada pela presença de 100 ou mais pólipos colorretais adenomatosos. Câncer colorretal ocorre em quase 100% dos indivíduos não tratados, com o diagnóstico de câncer por volta dos 45 anos. Colectomia ao diagnóstico inicial é fortemente indicada a pacientes com múltiplos adenomas grandes (>1cm) ou adenomas com histologia vilosa e/ou displasia de alto grau e polipose profusa. Pacientes na 2ª década de vida com adenomas esparsos e pequenos (<5mm) podem ser seguidos por meio de colonoscopia, com cirurgia adiada até acomodação nos estudos e trabalho. A cirurgia preferida na polipose profusa, incluindo o reto, é a proctocolectomia com anastomose ileoanal. Colectomia subtotal com seguimento ou colectomia total é aceitável àqueles com polipose adenomatosa familiar atenuada que tenham mínimo envolvimento retal (menos de 20 adenomas no reto).
Os fatores de risco para displasia de alto grau e carcinoma em pólipos são a histologia vilosa, a displasia de alto grau e o tamanho dos pólipos. Pólipos adenomatosos >1cm são fatores de risco para conter câncer colorretal.
As lesões de Dieulafoy são malformações vasculares e representam uma ruptura em vasos encontrados na submucosa gástrica
Em pacientes com metaplasia intestinal sem displasia em 2 exames consecutivos, a vigilância endoscópica deve ser estendida a cada 2 a 3 anos.
Com um achado anatomopatológico de metaplasia intestinal sem displasia, o tratamento cirúrgico é uma opção, e a técnica preconizada é a válvula 360°.
O achado anatomopatológico metaplasia intestinal com displasia de alto grau indica a ressecção esofágica.
adenocarcinoma de reto distal, localizado a 2cm da margem anal. Foi indicada uma ressecção abdominoperineal após a realização de terapia neoadjuvante ( ) Essa técnica cirúrgica envolve a dissecção pélvica, que é realizada no nível dos músculos elevadores do ânus.( ) A porção perineal dessa técnica excisa o ânus, os esfíncteres anais e o reto distal.( ) A indicação da técnica cirúrgica a ser realizada para o tratamento desse tumor envolve a determinação de sua relação com os esfíncteres anais, a extensão da invasão e a disseminação linfonodal.( ) O diagnóstico diferencial dessa lesão inclui colite ulcerativa, proctocolite de Crohn e úlcera retal solitária
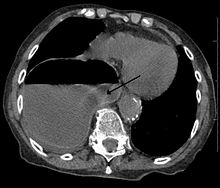
A aortografia é feita apenas no intraoperatório, nos casos de correção cirúrgica intravascular, já que apenas avalia a luz do vaso. No preparo pré-operatório, a angiotomografia é o exame mais adequado, já que pode avaliar, além do aneurisma e as suas dimensões, sua relação com outras estruturas, trombo, distância das artérias renais etc.
Os AAAs afetam primariamente os pacientes acima de 50 anos e são 2 vezes mais frequentes em homens do que mulheres. A incidência inicia-se com 50 anos e atinge o pico aos 80. Nas mulheres, o início é um pouco mais atrasado, aos 60 anos, com incidência crescente.
No caso dos Aneurismas da Aorta Abdominal (AAAs), o melhor exame de triagem é a ultrassonografia de abdome. A tomografia é um exame invasivo reservado para os casos em que a investigação continuará como pré-operatório.
A claudicação venosa apresenta-se com sintomas de sensação de peso e dor em membros inferiores, principalmente no final do dia, e alguns pacientes referem prurido associado. No exame físico, devem ser observados a hiperpigmentação, lipodermatoesclerose, edema depressível, presença de veias varicosas, presença de nevos, aumento do comprimento do membro e varizes de localização atípica. O principal sintoma encontrado em paciente com insuficiência arterial periférica crônica é a claudicação intermitente, caracterizada por dor em queimação ou fadiga na musculatura da panturrilha, desencadeada com a deambulação e que melhora com repouso. Inicialmente, os sintomas são intermitentes, entremeados com a capacidade de percorrer uma distância maior; com a evolução da doença esses sintomas vão ficando mais frequentes, desencadeados com distâncias menores. Além disso, a incidência de doença arterial obstrutiva periférica é mais comum em homens e aumenta com a passagem de cada década de vida, e está muito associada a fatores de risco como hipertensão arterial, diabetes e tabagismo.
A 5-alfarredutase é responsável pela conversão da testosterona em diidrotestosterona. Os bloqueadores da 5-alfarredutase são utilizados para tratamento de hiperplasia prostática benigna com efeito redutor no adenoma prostático. Porém, seu efeito é tardio, por volta de 6 meses, e tem o inconveniente de ter a diminuição da libido e ereção como seu principal efeito colateral (<5%). Devemos lembrar também que quando em uso de finasterida, o valor do PSA cai pela metade.
A formação do cálculo urinário tem início nos túbulos renais, onde ocorre um aumento da concentração de solutos, que podem tornar-se a matriz do futuro cálculo.
O curso do ureter começa posterior à artéria renal e continua ao longo da borda anterior do músculo psoas. Os vasos gonadais cruzam anteriormente o ureter nessa região. Assim que adentra a pelve, o ureter cruza anteriormente os vasos ilíacos, geralmente na altura da bifurcação em vasos ilíacos internos e externos, servindo então como marco anatômico para a identificação dessa estrutura.
A doença metastática no câncer de pâncreas geralmente atinge o fígado, o peritônio, o pulmão e, menos frequentemente, os ossos. Icterícia e dor abdominal são os sintomas mais comuns. A ultrassonografia possui boa sensibilidade para lesões >3cm, e geralmente há dilatação das vias biliares associada. A imagem da metástase possui achados variáveis.
Os sítios mais comuns de metástase do câncer colorretal são os linfonodos regionais, o fígado (pela drenagem venosa do trato intestinal via sistema portal), o pulmão e o peritônio. Os sinais e sintomas são os referidos à área da metástase, e os achados à ultrassonografia são variáveis.
O CHC é o tumor hepático primário maligno mais comum em adultos. Entre 80 e 90% dos casos ocorrem no fígado cirrótico. Os sintomas relacionam-se a diagnóstico tardio e são muito inespecíficos, como fraqueza, mal-estar, anorexia, dor abdominal, perda de peso e de massa abdominal e icterícia obstrutiva. Nível de alfafetoproteína >500µg/L é geralmente aceito como diagnóstico. Achados sugestivos à ultrassonografia são margens mal delimitadas e ecos internos irregulares, sendo os pequenos geralmente hipoecoicos e os grandes iso ou hiperecoides.
As lesões secundárias compreendem o maior grupo de tumores hepáticos malignos. A causa mais comum de metástases hepáticas é o câncer colorretal, seguido pelos carcinomas broncogênico, de próstata, de mama, de pâncreas, de estômago, de rim e de colo uterino. Os principais sítios de metástase do melanoma cutâneo são pele, tecido subcutâneo, pulmão e cérebro. Na ultrassonografia, os achados são variáveis; metástases hipervasculares ocorrem no tumor neuroendócrino, carcinoma de células renais, câncer de mama, melanoma e câncer da tireoide. A alfafetoproteína é uma glicoproteína normalmente produzida durante a gestação pelo fígado fetal e pelo saco embrionário, podendo estar aumentada nos pacientes com carcinoma hepatocelular (CHC
O ligamento redondo do fígado é formado pela obliteração da veia umbilical no feto e começa na cicatriz umbilical, percorrendo a linha mediana e se fixando ao fígado abaixo do ligamento falciforme, até a veia porta esquerda.
O ligamento hepatorrenal é a extensão do peritônio parietal que faz ponte entre a fáscia perirrenal e a parte posterior do fígado, e que cobre o polo superior do rim direito.
CA PULMAO: O adenocarcinoma é o tipo histológico mais frequente e tende a metastizar mais precocemente e geralmente para o sistema nervoso central.
O carcinoma broncoalveolar possui o melhor prognóstico, pois é altamente diferenciado e pode se manifestar como nódulo único ou múltiplos ou um infiltrado parenquimatoso difuso.
Os carcinomas de células escamosas apresentam tendência a sofrer necrose central e cavitação, com formação de abscessos pulmonares.
O câncer de pequenas células caracteriza-se por tendência muito agressiva a se metastizar, disseminando-se precocemente para os linfonodos mediastinais e sítios a distância, especialmente medula óssea e cérebro.
Por questões de temperatura, os testículos migram do retroperitônio para o escroto, e, assim, toda vascularização e drenagem linfática se faz por via retroperitoneal. O principal sítio metastático por conseguinte é a região retroperitoneal, denominado estadio II do câncer testicular. Quando há metástase para outros órgãos, como pulmão e cérebro, denominamos estadio III.
exames padrão-ouro para diagnóstico dos traumatismos urológicos - trauma renal: tomografia com contraste intravenoso; trauma ureteral: pielografia retrógrada; trauma vesical: cistografia retrógrada; e trauma uretral: uretrografia retrógrada.
I - Ovário II - Colorretal III - Tumor estromal gastrintestinal IV - Carcinoma hepatocelular V - Câncer de pâncreas ( II) Antígeno carcinoembrionário(IV )Alfafetoproteína(I ) Antígeno 125(III ) c-Kit ou CD-117(V ) Antígeno 19-9
Ostomias: necessário que:
Preservação de gordura subcutânea para apoio da ostomia
Mobilização adequada do intestino para evitar tensão sobre a ostomia
Serosa do intestino que não deve ser desnudada em mais de 5cm do mesentério
Fechamento mesentérico-peritoneal
Cicatrização
Macrófago: recrutamento e ativação celular e fagocitose com função antimicrobiana
Fibroblastos: síntese de componentes da matriz
Linfócitos: produção de citocinas estimuladoras de fibroblastos e inibição da saída de macrófagos do local lesado
Miofibroblastos: ativação de plaquetas que promovem a hemostasia e estimulam a angiogênese
o carcinoma de células escamosas do pulmão apresenta tendência a sofrer necrose central e cavitação
Os marcadores produzidos pelos tumores de testículo são: alfafetoproteína, DHL e beta-HCG. Os tumores de testículo são 1 a 1,5% dos tumores malignos do sexo masculino. Podem ser classificados em tumor de células germinativas (95%), tumores estromais gonadais e tumores mistos não classificados (5%). Os tumores de células germinativas são subdivididos em seminomatosos e não seminomatosos. Os tumores não seminomatosos são 55% dos casos e incluem o carcinoma embrionário, teratocarcinoma, teratoma e coriocarcinoma. Já os seminomatosos são 45% dos casos e são divididos em clássicos (80%), anaplásicos (10%) e espermatocíticos (10%). Os tumores podem ser mistos, isto é, ter componente seminomatoso e não seminomatoso ao mesmo tempo. Cerca 80 a 85% dos tumores não seminomatosos terão alfafetoproteína e beta-HCG elevados. Nos seminomatosos, podemos ter presente o beta-HCG aumentado e, se houver aumento da alfafetoproteína, componente não seminomatoso deve ser considerado (pior prognóstico). O DHL é importante no registro de doença metastática e tem melhor prognóstico.
o padrão-ouro para o diagnóstico de tumor de testículo é o anatomopatológico. Como a alfafetoproteína está presente somente nos não seminomas, em qualquer paciente com diagnóstico firmado pelo patologista associado a elevação deste marcador, o diagnóstico de não seminoma será fechado.
Para o tratamento cirúrgico das metástases de carcinoma colorretal, são necessários o controle do foco primário, a quimioterapia sistêmica e a exclusão de outros focos de metástases. O que determina a ressecabilidade cirúrgica não é o número de lesões, mas sua localização anatômica e sua relação com as veias hepática e porta. Um consenso define irressecabilidade absoluta como doença extra-hepática intratável, ausência de condições para cirurgia, ou envolvimento de mais de 70% do fígado ou 6 segmentos.
Os pacientes com intestino curto desenvolvem hipersecreção ácida gástrica, que pode estar associada à desativação de enzimas pancreáticas, uma redução do pH ideal necessário para absorção de gordura e um aumento na perda de fluidos intestinais. Nesses casos, indica-se o uso de um bloqueador H2 ou inibidor da bomba de prótons. Pacientes com ressecção ileal >100cm podem evoluir com diarreia secretória devido à má absorção de sais biliares, e má absorção de gordura e vitamina B12. Colestiramina pode melhorar a diarreia associada à má absorção de sais biliares, por ser um quelante de sais biliares. Loperamida resulta em diminuição na produção de fezes e pode ser útil nesses pacientes.
Resposta metabolica ao trauma: O sistema nervoso central é responsável pela iniciação da resposta metabólica diante do insulto. Já o sistema nervoso periférico atua na transmissão dos sinais aferentes. Observam-se o aumento dos hormônios contrarreguladores (glicocorticoides, glucagon e catecolaminas), a amplificação e a manutenção da resposta metabólica pela ação de citocinas pró-inflamatórias (fator de necrose tumoral - TNF -, interleucinas 1 e 6 - IL-1 e IL-6) e o aumento da atividade oxidante. Por outro lado, há diminuição da secreção de insulina e aumento da resistência insulínica. Na fase catabólica inicial, predominam catecolaminas, corticosteroides e glucagon, com queda significativa da insulinemia. Nesse ambiente, ocorre balanço nitrogenado negativo, independente da oferta de glicose e quebra de proteínas e de triglicérides que acabam alimentando a gliconeogênese hepática e a formação de corpos cetônicos. O catabolismo lipídico é mediado pelas catecolaminas, em especial as que exercem atividade beta. As de atividade alfa levam à inibição da reutilização de ácidos graxos.
Quanto ao seguimento endoscópico nos pacientes com Barrett, deve ser realizada EDA com biópsia (nos 4 quadrantes a cada 2cm), de acordo com o seguinte guideline: American Gastroenterological Association - sem displasia a cada 3 a 5 anos.
Nas displasias de baixo grau, além do acompanhamento endoscópico a cada 6 meses, deve-se aumentar a dose do IBP (dobrar) e acompanhar por 1 ano.
Nos pacientes com displasia de alto grau sem indicação cirúrgica, a ressecção endoscópica pelas técnicas de mucosectomia e dissecção submucosa endoscópica, associadas às terapêuticas ablativas (radiofrequência, crioterapia), vêm se mostrando promissoras por permitirem adequada avaliação do tecido devido às grandes ressecções.
Se a displasia não for confirmada por um 2º patologista, recomenda-se dobrar a dose do IBP e realizar nova biópsia em 3 meses.
Na displasia de alto grau, ou carcinoma intramucoso, o diagnóstico deve ser confirmado por 2º patologista, e, se comprovada, a melhor terapia é a cirúrgica com esofagectomia (única terapia que claramente remove todo o epitélio neoplásico com qualquer malignidade oculta e linfonodos regionais).
As mulheres são de 2 a 4 vezes mais suscetíveis a hérnia paraesofágica do que os homens.
O reparo cirúrgico nas hérnias paraesofágicas é indicado aos sintomáticos, sendo os princípios gerais a redução do conteúdo herniário com ressecção do saco herniário e a correção do defeito.
Dilatação endoscópica é indicada para megaesôfago graus I e II, megaesôfago incipiente, cirurgia prévia com sintomas persistentes, pacientes sem condição cirúrgica como opção para melhorar a nutrição e para gestantes.
O nifedipino e o nitrato de isossorbida utilizado antes das refeições podem provocar alívio da disfagia na acalasia em 50 a 90% dos pacientes, mas 30% apresentam efeitos colaterais (hipotensão e cefaleia), limitando seu uso.
O espasmo esofágico difuso é uma síndrome clínica caracterizada por dor torácica e/ou disfagia e achados manométricos e radiológicos característicos. É uma doença rara que acomete 4 a 5% dos pacientes com disfagia e/ou dor torácica. Caracteriza-se manometricamente pela presença de mais de 20% de aperistalse intermitente nas deglutições úmidas, alternadas com peristalse normal. Há também contrações repetitivas (3 picos), duração prolongada (maior que 15 segundos), aumento de amplitude, contrações espontâneas e anormalidades no esfíncter esofágico inferior (hipertonia ou acalasia). Ao esofagograma, o achado de esôfago "em saca-rolha" é típico.
Cancer de esofago: presença de metástases peritoneal, pulmonar, óssea, adrenal, cerebral ou hepática, ou linfonodos extrarregionais (para-aórticos, mesentéricos) contraindica a cirurgia. Metástases linfonodais celíacas e mediastinais/supraclavicular são consideradas regionais pelo novo escore TNM de 2010 (é o número de linfonodos envolvidos, e não a localização que determina o N). Em uma última revisão do AJCC/UICC, estadio TNM doença irressecável inclui invasão da aorta, traqueia, coração, grandes vasos ou presença de fístula traqueobrônquica. A cirurgia mais radical é a chamada esofagectomia em 3 campos. Nela há a abordagem por intermédio de um acesso abdominal, torácico e cervical, permitindo dissecção bastante ampla do esôfago, além de contar com a ressecção dos linfonodos das cadeias mediastinais, cervicais e abdominais. Assim, pacientes com boas condições nutricionais e respiratórias, com tumores ressecáveis do terço médio, são os principais candidatos a tal procedimento, lembrando que lesões mais precoces têm melhores resultados.
Paciente com risco aumentado de câncer gástrico (alterações predisponentes ou história familiar) podem se beneficiar do seguimento endoscópico. O risco de câncer é proporcional à extensão da metaplasia intestinal. Sugere-se endoscopia anual àqueles com achados endoscópicos de alto risco (displasia, metaplasia intestinal, gastrite atrófica, hiperplasia foveolar, alterações regenerativas, pólipos ou úlceras gástricas), podendo levar à detecção precoce do câncer e possível melhora na sobrevida.
Segundo o IV Consenso de Maastricht, a erradicação do H. pylori tem o potencial de prevenir o câncer gástrico. A metaplasia intestinal tem se tornado indicação estabelecida da erradicação, apesar de o retardo na progressão da metaplasia não poder prevenir completamente o câncer gástrico.
As indicações do tratamento do H. pylori pelo II Consenso Brasileiro são úlcera gastroduodenal, linfoma MALT de baixo grau, pós-cirurgia para câncer gástrico avançado em submetidos à gastrectomia parcial, pós-ressecção de câncer precoce (via endoscópica ou cirúrgica) e gastrite histológica intensa.
O princípio da cirurgia da úlcera péptica duodenal é associar um procedimento que diminua a secreção ácida por meio de vagotomia ou gastrectomia com ressecção do maior número possível de células produtoras de ácido. Deste modo, necessita-se também de um procedimento de drenagem, uma vez que a vagotomia foi realizada (podendo ocasionar estase gástrica), que pode ser gastroenteroanastomose (BI, BII ou em Y de Roux) ou piloroplastia.
Os pacientes com intestino curto desenvolvem hipersecreção ácida gástrica, que pode estar associada à desativação de enzimas pancreáticas, uma redução do pH ideal necessário para absorção de gordura e um aumento na perda de fluidos intestinais. Nesses casos, indica-se o uso de um bloqueador H2 ou inibidor da bomba de prótons. Pacientes com ressecção ileal >100cm podem evoluir com diarreia secretória devido à má absorção de sais biliares, e má absorção de gordura e vitamina B12. Colestiramina pode melhorar a diarreia associada à má absorção de sais biliares, por ser um quelante de sais biliares. Loperamida resulta em diminuição na produção de fezes e pode ser útil nesses pacientes
Infecções oriundas do estômago, duodeno, via biliar e delgado proximal podem ser causadas por germes aeróbios Gram positivos e negativos e organismos facultativos. Nas infecções comunitárias intra-abdominais, o uso de antibióticos empíricos deve ser contra Gram negativos aeróbios entéricos, bacilos facultativos e cocos Gram positivos betalactâmicos suscetíveis.
Independente das técnicas utilizadas, as cirurgias bariátricas são indicadas para as seguintes situações: Com relação à massa corpórea: - IMC >40kg/m², independente da presença de comorbidades; IMC entre 35 e 40kg/m² na presença de comorbidades; IMC entre 30 e 35kg/m² na presença de comorbidades. As doenças precisam ter a classificação "grave" por um médico especialista na respectiva área da doença. Também é obrigatória a constatação de "intratabilidade clínica da obesidade" por um endocrinologista. Com relação à idade: - Abaixo de 16 anos: não há estudos suficientes que corroborem essa indicação, com exceção aos casos de Prader-Willi ou outras síndromes genéticas similares. Nessas situações, o paciente deve ser operado com o consentimento da família. Não há dados seguros que contraindiquem os procedimentos ou comprovem prejuízos para paciente dessa faixa etária submetido a cirurgias da obesidade. Recomendações: avaliação de riscos pelo cirurgião e respectiva equipe multidisciplinar, registro e documentação detalhados e aprovação expressa dos pais ou responsáveis; - Entre 16 a 18 anos: sempre que houver indicação e consenso entre a família e a equipe multidisciplinar; - Entre 18 e 65 anos: sem restrições quanto à idade; - Acima de 65 anos: avaliação individual pela equipe multidisciplinar, considerando risco cirúrgico, presença de comorbidades, expectativa de vida e benefícios do emagrecimento. Para a escolha do procedimento, considerar limitações orgânicas da idade, como dismotilidade esofágica e osteoporose. Não há contraindicações formais com relação a essa faixa etária. Com relação ao tempo da doença: - Sempre que o paciente apresentar IMC e comorbidades em faixa de risco há pelo menos 2 anos, além de ter realizado tratamentos convencionais prévios e tido insucesso ou recidiva do peso, verificados por dados colhidos no histórico clínico do paciente. Essa exigência não se aplica: em casos de pacientes com IMC maior do que 50kg/m² e para pacientes com IMC entre 35 a 50kg/m², com doenças de evolução progressiva ou risco elevado.
São contraindicações à cirurgia bariátrica: depressão maior ou psicose não tratada, desordens alimentares, abuso de drogas e álcool. Pacientes com sobrepeso não têm indicações com suporte na literatura para cirurgia bariátrica. História familiar de câncer é contraindicação relativa; os pacientes devem realizar endoscopia e pesquisa de H. pylori, o qual deve ser erradicado se positivo. As cirurgias são indicadas, com relação à massa corpórea, em caso de IMC >40kg/m², independente da presença de comorbidades
A úlcera péptica não é fator de risco para câncer gástrico, mas toda úlcera gástrica deve ser diferenciada de malignidade precoce com biópsias durante a endoscopia.
O tipo de adenocarcinoma difuso é um tumor produtor de mucina, composto por células separadas ou pequenos agrupamentos de células com secreção mucinosa, distribuída por todo o citoplasma das células ou dispersa no estroma. Quando a mucina intracelular é abundante, ela empurra o núcleo lateralmente, resultando nas chamadas células "em anel de sinete". Os tumores carcinoides do trato digestivo são neuroendócrinos bem diferenciados e não adenocarcinomas.
Pela classificação histológica de Lauren, os adenocarcinomas gástricos podem ser divididos em 2 subtipos: intestinais e difusos.
tumores anaplásicos ou indiferenciados da tireoide: É mais comum em mulheres (como os carcinomas bem diferenciados). c) O crescimento é muito rápido com alta invasividade. d) Tem o pior prognóstico de todas as neoplasias tireoidianas. e) É muito indiferenciado e não capta iodo.
Os tumores malignos de pulmão são classificados em 2 grandes subtipos histológicos: Pequenas Células (PC) e Não Pequenas Células (NPC). Sendo o PC o tumor de pior prognóstico, devido ao alto índice de metástases ganglionares no momento do diagnóstico. A lobectomia pulmonar com esvaziamento mediastinal é o melhor tratamento para os tumores de pulmão NPC em estadio não avançado. Ficando QT e RT como escolha para os estadios avançados e nos tumores de PC. A tosse é o sintoma mais precoce da câncer de pulmão, ficando a perda de peso detectável nos casos mais avançados.
As massas mediastinais mais comuns de localização intermediária são os cistos pericárdicos ou broncogênicos e de localização posterior são os tumores do tecido neural, portanto benignas em sua grande maioria. A causa mais comum de mediastinite aguda é perfuração esofágica, principalmente após manipulação endoscópica. A causa mais comum de síndrome da veia cava são os tumores de pulmão. O principal responsável pela SVCS é o câncer do pulmão, com incidência de aproximadamente 70% dos casos. O carcinoma de pequenas células é o subtipo histológico mais frequente (38%), devido às extensas metástases linfonodais que esses tumores acarretam. Os linfomas (principalmente, do subtipo esclerótico), os timomas e os tumores de células germinativas são outras causas neoplásicas primárias. Os tumores de linhagem germinativa correspondem a cerca de 20% das lesões neoplásicas que acometem o compartimento mediastinal anterior. A classificação mais comum separa os teratomas benignos, as neoplasias seminomatosas e as neoplasias embrionárias ou não seminomatosas. O tratamento dos seminomas ainda causa controvérsias. Os seminomas histologicamente puros, sem outros elementos embrionários, são altamente radiossensíveis. Na doença disseminada, a quimioterapia é eficiente, principalmente se associada à radioterapia. O papel da cirurgia, nesses casos, não está bem definido. Os tratamentos combinados e as ressecções agressivas (com intuito, tanto citorredutor quanto de ressecamento de massas residuais) mostram resultados melhores que as indicações de tratamento isolado nos tumores não seminomatosos. A maioria dos tumores mediastinais ocorre em adultos, entre 40 e 60 anos.
Critérios de Roma III para SII: - Dor abdominal recorrente pelo menos 3 dias por mês nos últimos 3 meses, associado a 2 ou mais:? Melhora com evacuação;? Início associado a alteração na frequência das fezes;? Início associado a alteração na forma das fezes. Os critérios devem ser preenchidos nos últimos 3 meses, com início dos sintomas pelo menos 6 meses antes do diagnóstico.
A indicação mais comum de cirurgia são as obstruções e fístulas ao longo do curso da doença. Em pacientes com colite fulminante deve ser instituído corticoterapia de pulso. A azatioprina é utilizada como manutenção e prevenção de crises. A doença é mais comum em judeus e caucasianos. Os abscessos crípticos são muito sugestivos da doença, mas não fazem o diagnóstico.
Sangramento retal é o sintoma inicial mais comum do câncer anal, em 45%. Dor anorretal e sensação de massa estão presentes em 30%. No carcinoma escamocelular, história prévia de condiloma está presente em cerca de 50% dos homens homossexuais. O tratamento para o carcinoma escamocelular de canal anal mais indicado é a quimiorradioterapia combinada. Já o tratamento do adenocarcinoma do canal anal segue os mesmos princípios do câncer retal, com ressecção cirúrgica como tratamento primário e quimioterapia e radioterapia como adjuvantes.
Pacientes com fístula anorretal geralmente se apresentam com abscesso anorretal seguido de drenagem ou drenagem purulenta crônica e lesão pustulosa, na área perianal ou nas nádegas. Dor retal intermitente, particularmente durante a evacuação, pode ocorrer. O tratamento cirúrgico é a principal terapia e é requerido nas fístulas sintomáticas, exceto a doença de Crohn.
Dor associada a hemorroidas e nódulo palpável resulta de trombose que pode ser interna ou externa. A trombose externa pode ser associada a dor excruciante. A interna também pode causar dor, mas em grau menor. Organização e reabsorção do coágulo ocorrem após vários dias. O tratamento da trombose interna é usualmente conservador; rara exceção é a trombose externa e interna concomitante que requer hemorroidectomia. Na trombose externa com dor excruciante, pode-se realizar a evacuação cirúrgica do trombo, com alívio imediato. Uma alternativa é o uso de analgésicos tópicos e orais, laxativos e anhos de assento até resolução espontânea.
A localização mais comum da fissura anal primária é a linha média posterior do canal anal; somente 10% das mulheres e 1% dos homens têm uma fissura localizada na linha média anterior. Fatores que podem contribuir para a fissura posterior é a diminuição do fluxo sanguíneo, pressão no esfíncter elevatório interno maior na face anterior, favorecendo fissura posterior durante a evacuação e distribuição elíptica das fibras no esfíncter anal com menor suporte posterior. c) e e) qualquer fissura não localizada nas porções posterior ou anterior deve alertar para outros diagnósticos como a doença de Crohn.
A PAF (Polipose Adenomatosa Familiar) é uma síndrome clínica em que o cólon é sede de inúmeros pólipos adenomatosos, em número maior do que 100, e tem herança genética autossômica dominante com penetração incompleta. É causada por mutação germinativa no gene APC (Adenomatous Polyposis Coli), localizado no cromossomo 5q, um gene supressor tumoral responsável por modular a comunicação e a adesão celular. A probabilidade de câncer de cólon entre indivíduos com polipose familiar aproxima-se de 100% por volta dos 40 anos, estando, por isso, indicada colectomia profilática a todos aqueles com a doença, assim que ela é detectada.
A PAF e a síndrome de Gardner parecem ser uma só doença genética (originária da APC), com aspectos de apresentação que variam da presença de pólipos colônicos até a PAF com 1 ou mais manifestações extracolônicas. A síndrome de Gardner caracteriza-se pelo aspecto semelhante ao da PAF, com osteomas de grandes ossos e mandíbulas, tumores desmoides, tumores de partes moles (lipomas e cistos sebáceos, por exemplo) e dentes extranumerários associados.
A síndrome de Peutz-Jeghers caracteriza-se por doença autossômica dominante marcada por mutação do gene STK11 (serina-treoninaquinase), com múltiplos pólipos hamartomatosos em todo o trato gastrintestinal, associados a hiperpigmentação cutânea, principalmente na mucosa oral.
Outra variante rara da PAF, a síndrome de Turcot, caracteriza-se pela polipose adenomatosa associada a tumores malignos do sistema nervoso central (como o meduloblastoma e o glioblastoma).
A síndrome de Lynch é dividida em tipo I, em que há predomínio de câncer colorretal, e o tipo II, em que há tumores extracolônicos associados.
O câncer colorretal hereditário não associado à polipose é um distúrbio autossômico dominante, também conhecido como síndrome de Lynch. Em alguns casos, estão presentes 3 mutações: MSH6 (15% dos casos), MSH2 (32% dos casos) e MLH1 (39% dos casos) ou PMS2 (14% dos casos), modificando mecanismos envolvidos na reparação do DNA. Os pacientes em que se observa esse tipo de distúrbio apresentam pico de incidência do câncer colorretal entre os 40 e os 50 anos, embora 80% o desenvolvam aos 65 anos. Parece que os cânceres também se desenvolvem de adenomas, mas estes costumam ser maiores, planos, proximais, com mais displasia de alto grau e/ou histologia vilosa, progredindo muito mais rápido para câncer.
A síndrome de Lynch á associada a instabilidade microssatélite.
O sinal propedêutico de Jobert caracteriza-se pelo timpanismo à percussão da topografia hepática e sugere pneumoperitônio. O sinal de Chilaiditi é radiológico e traduz a presença de ar dentro de alças na mesma topografia, o que foge da indicação cirúrgica. Os sinais de Cullen e Grey Turner, por sua vez, caracterizam sangramento no retroperitônio. Apesar de a pancreatite ser causa comum, não é a única situação em que esses achados propedêuticos podem aparecer. O sinal de Fox (equimose na base do pênis) também pode estar presente em alguns casos de pancreatite aguda grave. Já o sinal de Rovsing (dor na fossa ilíaca direita pela compressão à fossa ilíaca esquerda) sugere apendicite aguda. E o sinal de Murphy (dor com interrupção da inspiração durante a compressão do rebordo costal direito) sugere colecistite aguda. A propedêutica que sugere colangite é a tríade de Charcot, composta de dor no hipocôndrio direito, febre e icterícia.
lesão de mais de 50% da circunferência do ducto, há grande risco de estenose caso se tente o reparo primário. O ideal no caso é anastomose do tipo hepatojejunal, terminolateral, em Y de Roux, no mesmo tempo cirúrgico.
A doença diverticular é a causa mais frequente de hemorragia digestiva baixa, seguida por angiodisplasias, sendo que o sangramento de ambas costuma ocorrer no cólon direito.
A maioria dos casos de hemorragia digestiva baixa no idoso se resolve espontaneamente. A colonoscopia pode ser realizada na vigência de sangramento, ainda que seja mais difícil do ponto de vista técnico; mesmo assim, deve ser tentada antes da arteriografia.
A necessidade calórica básica diária é variável, mas geralmente próxima de 25kcal/kg de peso corpóreo ideal
politraumatizados graves, em que a necessidade calórica aumenta para taxas de 30 a 35kcal/kg. Em queimados com comprometimento >50% da área corpórea, aumenta para 40kcal/kg.
ca anal: o carcinoma de células escamosas deve-se a infecção pelo papilomavírus humano
A doença de Paget é configurada por adenocarcinoma intraepitelial de margem anal. Não há associação com HPV.
Doença de Bowen trata-se de carcinoma de células escamosas intraepitelial in situ, e o tratamento é feito com ressecção de espessura total da pele comprometida, com margens livres, mesmo que para isso se façam necessários retalhos de avanço locais.
Fatores como condiloma anal (HPV) e outras doenças sexualmente transmissíveis, fístulas anais crônicas, doença de Crohn, estados de imunossupressão como a síndrome da imunodeficiência adquirida, radioterapia prévia, predisposição genética e tabagismo estão associados a maior incidência do carcinoma de células escamosas (CEC). O tratamento dessas lesões teve mudança radical quando Nigro observou que a associação de radioterapia local a quimioterapia (mitomicina e 5-fluoruracila) apresentava melhores resultados no controle local sem a necessidade de colostomia, sendo até hoje o tratamento de escolha.
nas feridas, a glicose é metabolizada anaerobicamente até lactato. O ácido láctico produzido é liberado na circulação e reconvertido em glicose no fígado, o que é conhecido como ciclo de Cori
Na peritonite grave com sepse, o hipermetabolismo está representado por aumento do gasto energético, aumento do consumo de oxigênio, maior débito cardíaco, maior produção de ácido carbônico, maior uso de carboidratos, gorduras e aminoácidos como substrato energético e menor excreção urinária de nitrogênio.
oferta proteica de 1,2 a 1,5g/kg/d nos pacientes com fístulas de baixo débito
de acordo com os critérios de Milão, propostos por Mazzaferro, podem ser incluídos em lista todos aqueles pacientes cuja(s) característica(s) do(s) tumor(es) se enquadrem nos critérios a seguir: uma lesão de até 5cm ou 3 lesões, sendo de 3cm o diâmetro da maior delas, sem invasão vascular e sem lesões extra-hepáticas
AM 10 – 20 mmHg acima dos valores prévios (PA sistólica 150 mmHg para aneurismas não clipados)





 AM 10 – 20 mmHg acima dos valores prévios (PA sistólica 150 mmHg para aneurismas não clipados)
AM 10 – 20 mmHg acima dos valores prévios (PA sistólica 150 mmHg para aneurismas não clipados)